2024年7月10日,我院陈报恩实验室在《美国科学院院刊》(PNAS)以长文在线发表了题为“Stearoylation cycle regulates the cell surface distribution of the PCP protein Vangl2”的研究论文。该研究揭示了平面细胞极性关键调节因子Vangl2的亚细胞定位和功能受到硬脂酰化修饰的动态调控。
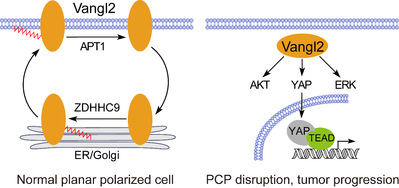
图1. 硬脂酰化修饰循环调控Vangl2的亚细胞定位和功能
平面细胞极性(planar cell polarity, PCP)主要表征蛋白质和细胞器在细胞平面上的不对称分布,对细胞间通信、胚胎发育、组织稳态等至关重要。PCP缺陷会导致多种人类疾病,包括出生缺陷、癌症等。因此,深入理解PCP的分子调控机制对基础和转化研究均具有重要意义。PCP的建立依赖于其核心组分的动态运输和不对称分布。Vangl2是PCP的核心组分,其功能异常和神经管缺陷(neural tube defects, NTD)、癌症等疾病关系密切。Vangl2的动态定位对其功能发挥十分关键,但调控Vangl2动态定位的分子机制尚不明确。蛋白质长链脂肪酰化(long-chain fatty acylation, LCFA)修饰能够显著增强蛋白质的疏水性与膜亲和性,对蛋白质的运输、亚细胞定位、蛋白质间的相互作用等具有重要影响。
陈报恩实验室运用基于点击化学原理设计的脂探针发现Vangl2是LCFA修饰的蛋白质,且对18碳硬脂酸(stearic acid)具有选择性。Vangl2硬脂酰化(stearoylation)发生在高度保守的第103位半胱氨酸残基。在正常极化细胞中,内质网和高尔基体中的酰基转移酶ZDHHC9催化Vangl2的硬脂酰化,促进其运输到细胞表面,而去脂肪酰化酶APT1则介导细胞膜上的Vangl2去硬脂酰化和回收(recycling);硬脂酰化缺陷会降低Vangl2的细胞膜定位,进而导致PCP破坏、激活YAP、AKT、ERK等致癌信号转导、促进癌症进展(图1)。总之,该研究揭示了PCP关键调节因子Vangl2的亚细胞定位和功能调控的新机制,建立了脂肪酸代谢紊乱和癌症、神经系统疾病等疾病之间的潜在联系,为发展Vangl2相关疾病的干预手段提供了理论依据。
陈报恩实验室2021级博士生应加富为论文的第一作者,陈报恩研究员为论文的通讯作者。该研究获得了国家自然科学基金委的项目资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2400569121.