2024年5月22日,我院朱永群实验室与浙江大学生命科学学院周艳课题组、北京大学刘小云课题组联合在Nature上在线发表了题为“Legionella effector LnaB is a phosphoryl-AMPylase that impairs phosphosignalling”的文章,发现了一类广泛存在于病原菌中新型的LnaB家族磷酰基单磷酸腺苷酸化酶效应蛋白,揭示了全新的磷酰基腺苷酸化修饰和调节磷酸化信号转导的方式,突破了磷酸化是终端化的、在细胞内不可被进一步共价修饰的传统概念。该工作还阐释了病原菌通过同一效应蛋白既保护宿主经典泛素通路,又抑制宿主免疫防御反应,以达到与宿主细胞短期共存的目的,实现了“绵里藏针”的致病策略。

单磷酸腺苷酸化修饰(AMPylation)是一种最早发现于1967年、广泛存在于原核生物和真核生物中的蛋白质翻译后修饰,在内质网应激、神经退行性疾病、适应性免疫等过程中发挥着重要作用。以往的研究发现,该修饰主要由Fic等家族单磷酸腺苷酸化酶(AMPylase)催化,将单磷酸腺苷酸(AMP)基团转移到靶蛋白上,之前鉴定出的单磷酸腺苷酸化修饰位点均发生在蛋白底物的苏氨酸、酪氨酸、丝氨酸等残基上。
嗜肺军团菌是导致人类军团病的致病菌,其感染肺巨噬细胞,在宿主细胞内形成独特的膜泡结构,从而生存和繁殖。2016年罗招庆、Ivan Dikic、Ralph Isberg和茅毓新等多个实验室先后发现,嗜肺军团菌利用SidE家族效应蛋白催化不依赖E1和E2的非典型泛素化过程,通过对泛素(Ub)第42位精氨酸残基进行ADP-核糖基化修饰(ADPRR42 -Ub)的中间步骤,最终将泛素以磷酸核糖基(P-ribose)共价连接到相关底物蛋白质的丝氨酸残基上,促进嗜肺军团菌膜泡的成熟,该非典型泛素化过程及其随后的效应蛋白DupA/B的作用,产生了磷酸核糖化泛素分子(PRR42-Ub)。 磷酸核糖化泛素分子(PRR42-Ub)对宿主具有细胞毒性,说明可能需要特殊的效应蛋白消除这些毒性泛素分子、或者对泛素进行其他修饰,才能有利于该菌在宿主细胞内生存、达到与宿主细胞短期的共存。
为了验证嗜肺军团菌是否存在特殊的效应蛋白消除PRR42-Ub、或者对泛素进行其他修饰,该研究建立了独特体外和体内筛选体系,发现其效应蛋白LnaB是一个独特的AMPylase(腺苷酸化酶),以ATP作为配体,以宿主肌动蛋白(actin)作为激活剂,对PRR42-Ub的磷酰基催化单磷酸腺苷酸化(AMPylation)修饰,从而生成ADPRR42-Ub。生成的ADPRR42-Ub进一步由效应蛋白MavL水解成为Ub。这个由LnaB和MavL催化形成的级联反应,实现了对非经典泛素化过程的逆转(图2),从而保护了对嗜肺军团菌胞内生存和宿主细胞正常生理过程都至关重要的经典泛素化通路。
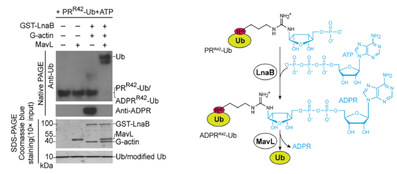
图2. LnaB和MavL催化形成的级联反应,实现了对非经典泛素化过程的逆转
该研究进一步发现LnaB能够抑制酵母生长,由于PRR42-Ub是由SidE家族效应蛋白产生,不是酵母本身存在的蛋白,说明LnaB在细胞内可能存在其他底物。不仅如此,过表达LnaB实验在293T细胞产生了大量的单磷酸腺苷酸化修饰信号。由于LnaB作用于PRR42-Ub的磷酸核糖基的磷酰基,而磷酰基广泛存在于所有磷酸化蛋白上,说明LnaB可能修饰磷酸化蛋白。
随后实验发现,过表达持续激活形式的酪氨酸激酶NPM-ALK或者加入磷酸酶抑制剂冈田酸处理后,都会显著增加LnaB催化AMPylation的水平。利用质谱技术,发现LnaB能够对含有磷酸化丝氨酸、磷酸化苏氨酸和磷酸化酪氨酸残基的多肽类底物,进行磷酰基单磷酸腺苷酸化,进而产生特殊的ADPylation修饰(图3)。
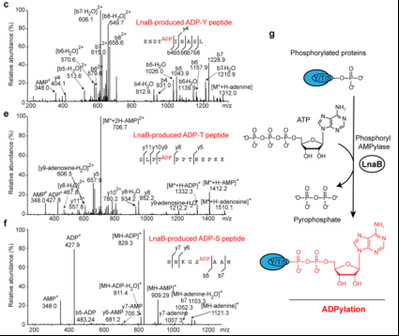
图3. LnaB对磷酸化多肽催化腺苷酸化并产生ADPylation修饰
该研究发现在感染过程中,LnaB对宿主细胞内至关重要的Src家族激酶的活化环(activation loop)上保守磷酸化酪氨酸残基进行磷酰基单磷酸腺苷酸化。修饰后的Src家族激酶丧失了活性,抑制了下游磷酸化信号转导,从而抑制了其介导免疫信号通路。LnaB也是迄今为止唯一鉴定出的可以直接修饰Src家族激酶活化环上磷酸化酪氨酸残基的细菌毒力因子。
该研究随后通过同源搜索,鉴定出了162个LnaB同源蛋白,它们广泛分布于20多个不同菌属中,构成一类新型的磷酰基单磷酸腺苷化酶家族。该家族成员具有两个保守的独特SG和H-E催化基序,与先前发现Fic家族的结构不同,具有新型的折叠模式。结构研究显示,肌动蛋白结合到LnaB的C端,稳定其催化结构域中的β发夹结构,保证配体ATP的结合,从而激活LnaB的酶学活性。该家族的161个成员具有三型、四型或者六型分泌系统的分泌信号肽,表明它们可能作用于相应的靶细胞,有1个成员没有分泌信号肽,其可能作用于细菌自身。
该项研究有以下几点重要发现和概念突破:
1. 发现了一类不同于以往的、具有独特催化基序和结构特征的磷酰基单磷酸腺苷酸化酶(Phosphoryl-AMPylase)新家族;
2. 发现了靶向磷酰基的腺苷酸化(AMPylation)修饰,突破了AMPylation只发生在蛋白质氨基酸残基上的概念;
3. 发现了调节磷酸化信号转导的全新方式,突破了磷酸化是终端化的、在细胞内不可被进一步共价修饰的传统概念;
4. 定义了一种新型的蛋白质翻译后修饰,即ADPylation修饰;
5. 揭示了病原菌利用同一效应蛋白既保护宿主泛素通路,又抑制宿主免疫防御,达到与宿主短期共存目的,实现“绵里藏针”的致病策略(图4);
6. LnaB家族的发现揭示了一种病原菌保守的调节宿主信号通路的机制,为病原菌致病性和效应蛋白的研究提供新思路。
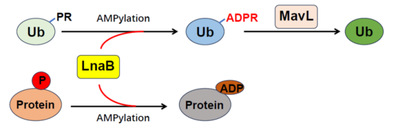
图4. LnaB工作机制的示意图
这项研究鉴定出的ADPylation修饰,扩展人们对蛋白质翻译后修饰的认识,证明了磷酸化蛋白磷酰基团修饰的可行性,为蛋白质功能和信号转导提供新的调控机制。由于Src家族激酶在人类多种疾病中发挥重要作用,对LnaB的独特活性进行开发,对相关疾病治疗具有潜在的应用价值。进一步研究LnaB家族效应蛋白的功能,将开辟病原菌效应蛋白研究的新方向。
博士生王婷、硕士生宋晓楠和博士后谭加兴为本文的共同第一作者,朱永群教授、周艳研究员和刘小云研究员为本文共同通讯作者,参与研究的还有博士生冼伟、周星彤、虞铭汝、王小飞、徐艳、吴婷、苑轲轲、冉宇和杨兵教授、范高峰教授。其中刘小云研究员、冼伟和周星彤分别在质谱分析和结构方面做了重要贡献,范高峰教授在磷酸化多肽和磷酸化信号转导方面提供了热情帮助。该研究的顺利实施还要感谢清华大学江鹏、浙江大学冯新华、余奕、徐平龙、南京医科大学季晨博、中山大学陆勇军和普渡大学罗招庆等教授们的大力支持。该研究获得了国家基金委、科技部重点研发专项、中组部青年拔尖人才等资助。
原文链接:https://www.nature.com/articles/s41586-024-07573-z