2024年1月3日,我院陆华松研究员与杨兵研究员团队合作在Nature Cell Biology在线发表题为“A chaperone-like function of FUS ensures TAZ condensate dynamics and transcriptional activation”的研究论文。该工作揭示生物大分子凝聚体物质属性与其功能维持的紧密联系,发现FUS能扮演“分子伴侣样”角色,维持TAZ凝聚体液态流动性,从而促进其转录活性的重要功能。我院博士研究生邵阳晴、舒鑫(已毕业)和同济大学医学院卢毅研究员是该论文的共同第一作者,陆华松研究员和杨兵研究员是本文共同通讯作者。
生物大分子的区室化分布是决定各类细胞活动和代谢反应高效性和特异性的基础。除了经典的有膜细胞器,生物分子还能通过相分离等机制形成种类繁多的无膜凝聚体,发挥重要功能。具有生理功能的无膜凝聚体能不断地与周围环境进行分子交换,具有高度动态性和可逆性;而处于静态且不可逆的凝聚体通常呈现“固态”特征,会严重损害细胞功能并导致各种疾病发生。因此,解析无膜凝聚体的分子组成及可逆调控机制,对理解生物分子的异常聚集和开发相关疾病的干预与治疗方案具有重要意义。
Hippo信号通路广泛参与器官发育、组织大小调节和再生等生理活动,其活性调节异常也与肿瘤发生等病理过程密切相关。YAP/TAZ是Hippo信号通路的下游效应因子并调节靶基因表达。研究表明,TAZ能在细胞核中形成转录凝聚体,并招募多种转录因子促进靶基因表达。但是,TAZ凝聚体的组成因子有哪些?这些因子是否参与TAZ凝聚体的动态调控?如果是,它们又如何影响TAZ凝聚体功能?
为了回答上述问题,研究人员首先优化了具有邻近增强效应的化学交联剂,并建立了一套针对TAZ凝聚体的体外重构和交联质谱方案,用于绘制TAZ凝聚体蛋白互作图谱。通过组学分析、细胞和体外等实验,研究者筛选并验证了多个与TAZ凝聚体互作的候选因子,证实了该方案在无膜凝聚体组分解析中具有潜在的应用价值。
在一系列TAZ凝聚体互作因子中,研究者聚焦于FET家族成员FUS进行相关机制和功能探索。他们发现FUS的LCD结构域(Low complexity sequence domain)能与TAZ的CC结构域(Coiled-coil domain)直接互作,并受上游DNA-PK介导的LCD磷酸化调控。通过识别CC结构域,FUS能够显著地限制CC 结构域对TAZ凝聚体形成的驱动作用,并且该过程不受上游Hippo信号通路的影响。
犹如世上万物皆有始终,细胞内无膜凝聚体的稳态平衡是正向促进因子和负向限制因子共同作用的结果,因而具有动态流动性和可逆性。那么,FUS作为TAZ凝聚体的负向限制因子,对其稳态平衡和功能有怎样的影响呢?为此,研究人员以凝聚体的物质属性为切入点,探索FUS对TAZ凝聚体的影响。结果表明,FUS能够促进TAZ凝聚体内的分子流动性,使凝聚体呈现更为规则和圆润的形态。与之相反,FUS缺失时,TAZ凝聚体内分子流动性显著降低,整体呈现由“液态”向“固态”的转变。最后,研究人员发现FUS维持TAZ凝聚体的“液态”物质属性对其下游靶基因的表达和促进肿瘤能力是必不可少的。
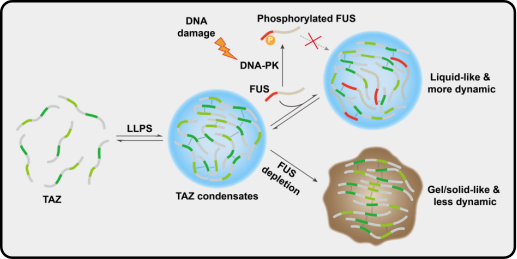
图1:FUS发挥“分子伴侣样”功能维持TAZ凝聚体“液态”物质属性和功能
综上,本研究首次利用交联质谱技术绘制了TAZ凝聚体的蛋白互作图谱,解析了FUS在TAZ凝聚体活性调节中的重要功能,也为研究凝聚体的物质属性与功能偶联提供了重要范例。该研究的开展得到了本院冯新华、赵斌、张龙等老师的大力支持,研究经费主要来自于国家自然科学基金面上项目,国家重大研究计划培育项目和浙江省杰出青年基金等项目。陆华松课题组聚焦于无膜凝聚体与基因表达在基因组稳定性维持、压力应答、肿瘤发生和细胞衰老等过程中的功能研究,实验室目前有多个方向的课题正在展开,欢迎感兴趣的同学联系与加入。
实验室主页:/syssy_40763/list.htm
原文链接:https://www.nature.com/articles/s41556-023-01309-3