2023年8月22日,我院周杰实验室与浙江大学医学院张兴教授实验室合作在国际学术期刊Nucleic Acids Research上在线发表了题为“Cryo-electron microscopy structure and translocation mechanism of the crenarchaeal ribosome”的研究论文(Breakthrough article),首次解析了泉古细菌Sulfolobus acidocaldarius (Sac) 中蛋白质翻译的分子机制。
自然界有三大王国。除了细菌和真核生物以外,古菌是生命第三领域的成员。古菌的原始祖先是一种极度嗜热的厌氧菌,包括两个古菌门,分别是广古菌Euryarchaeota和泉古菌Crenarchaeota。泉古菌假说(eocyte hypothesis)认为真核生物是从泉古菌进化而来。探索泉古菌中的蛋白质翻译,不仅有利于理解真核核糖体的进化,也有利于理解极端条件下的蛋白质翻译。
本研究以 2.7-5.7 Å 的分辨率解析了来自Sulfolobus acidocaldarius (Sac)的古菌核糖体的 10 种冷冻电镜(cryo-EM)结构。在亚基结构中,观察到 H68 和 h44 rRNA 的不稳定构象,这可能会干扰亚基结合,同时也发现了 12 个rRNA 扩展片段和3个新的核糖体蛋白,对了解古菌在极端条件下生长提供一定的结构见解(图1)。50S-aRF1 核糖体复合体的结构显示了 aRF1 的独特结构域方向,可能解释了在翻译终止阶段,位于P位点的tRNA是如何被释放出来的。
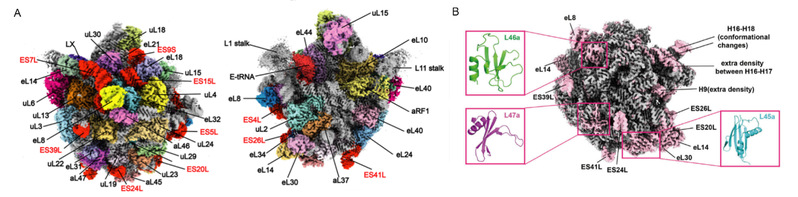
图1:2.7 Å 分辨率的50S核糖体结构揭示的新的核糖体蛋白及rRNA扩展片段。
Sac 70S 复合物在 tRNA 移位的七个不同阶段被捕获,证实了古菌核糖体移位过程中的保守结构特征。该研究还鉴定出两个新的移位过程中间态,解释了移位后期阶段,核糖体如何释放已经移动了的tRNA的分子机制。即在 aEF2 结合的 70S 核糖体复合物中,基于 30S 头部结构域的3D 分类确定了两个新的移位中间体复合物,其中 30S 头部结构域倾斜 5°-6º 以使其能够与移位的 P位点tRNA 脱离,从而释放tRNA到E位点(图2)。同时可以观察到aEF2的III-V结构域的构象变化。以上结构为古菌翻译和核糖体移位提供了新的见解。
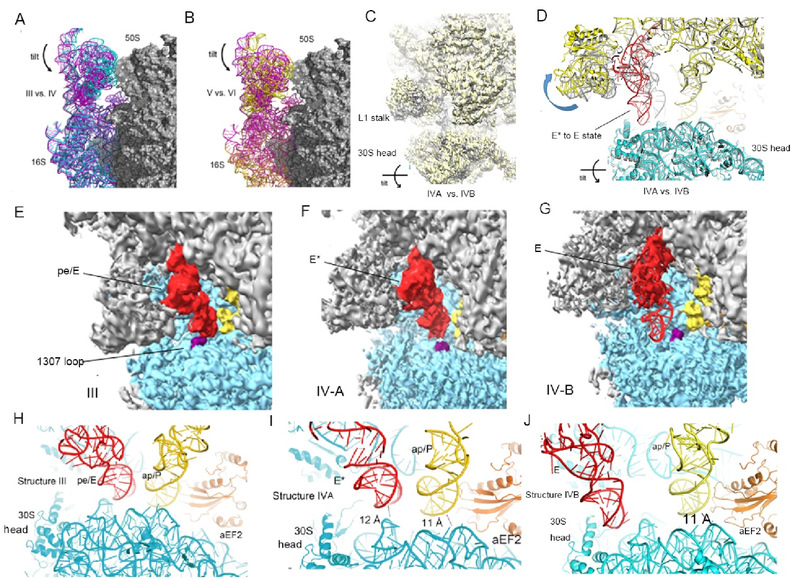
图2:新的核糖体移位中间态解释了tRNA移动以后核糖体如何释放它们从而完成核糖体移位。
综上,该研究工作全面深入地阐释了古细菌核糖体结构以及新的核糖体移位的分子机制。为理解古细菌中的核糖体翻译以及核糖体移位具有重要意义。
该工作得到了国家自然科学基金面上项目(31971226),浙江省杰出青年科学基金(LR20C050003)、中央高校基金科研项目业务费(2018QN81010)等项目的资助。博士研究生王颖慧,戴红,张玲为论文的共同第一作者,王靖芬,王晨,吴赟等也参与了电镜数据收集以及结构解析方面的工作。
原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad661/7244779?searchresult=1