成体骨骼的发育、维持和重塑由多种区域特异性骨骼干细胞(Skeletal stem cells, SSCs)共同维持。骨髓、生长板和骨膜均含有具备SSC特性的细胞类群,然而其异质性和功能差异并没有得到深入解析。瘦素受体阳性(LepR+)骨髓基质细胞(Bone marrow stromal cells, BMSCs)最早被发现能够通过分泌Scf和Cxcl12来维持造血干细胞微环境【1,2】。遗传谱系示踪研究发现成体LepR+细胞富集了骨髓SSCs,其能够自我更新并分化产生成骨细胞和脂肪细胞,还可以在骨骼损伤后分化产生软骨细胞【3】。在长骨中特异性敲除LepR后会破坏骨骼稳态,导致SSC成骨分化增加、成脂分化减少以及骨折愈合加速【4】。虽然LepR+细胞在成体骨骼维持和损伤修复中至关重要,但是其异质性仍然不明确。深入解析稳态和应激状态下LepR+细胞的功能亚群以及关键转录调控网络对促进骨骼损伤修复和治疗骨质疏松等重大骨科疾病意义重大。
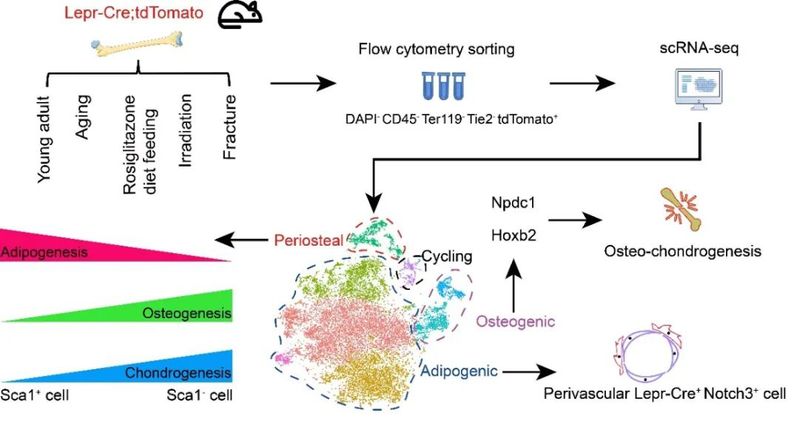
2021年12月27日,同济大学生命科学与技术学院、附属东方医院再生医学研究所岳锐实验室联合我院沈立实验室在EMBO Journal在线发表了题为Single-cell transcriptomics of LepR-positive skeletal cells reveals heterogeneous stress-dependent stem and progenitor pools 的论文。该研究通过对五种不同生理和应激状态下的长骨LepR+细胞进行单细胞转录组测序(scRNA-seq),绘制了全面深入的成体骨骼干祖细胞图谱。结合体内外功能实验,研究人员发现了一个紧贴骨髓血管壁且相对静息的Notch3+细胞亚群,以及一个位于骨外膜且成克隆和成脂分化能力较强的Sca-1+细胞亚群。此外,研究人员还发现了多个能够促进成骨和成软骨的关键转录因子(如Hoxb2和Npdc1等),从而为促进骨折损伤修复提供了新思路。

研究人员首先结合小鼠遗传谱系示踪系统和scRNA-seq,平行比较了Prxx1-Cre(最常用的四肢骨骼特异性Cre)和Lepr-Cre标记细胞的异同。结果显示Prrx1-Cre比Lepr-Cre标记了更多的软骨细胞、平滑肌细胞和骨膜细胞,但是两者在BMSCs和成骨细胞类群中的标记效率相当。接下来,研究人员通过对五种不同生理和应激状态下(年轻小鼠、老年小鼠、罗格列酮喂食、亚致死剂量辐照、长骨骨折)的Lepr-Cre; tdTomato小鼠长骨进行流式分选和scRNA-seq。生物信息学整合分析将17224个单细胞划分为8个类群,主要包括了成脂(Adipogenic)、成骨(Osteogenic)、骨外膜(Periosteal),以及分裂期(Cycling)等四大类群。
成脂细胞类群主要包含高表达Scf和Cxcl12等造血维持因子的多个BMSC亚群。该类群高表达Adipoq和Lpl但不表达成熟脂肪细胞标志物Perilipin,暗示其具有成脂潜能但并非终末分化的脂肪细胞。研究人员通过生信分析发现了一个Notch3+细胞亚群,其主要处于G1期并表达最高水平的造血维持因子。BrdU掺入实验显示,Lepr-Cre+Notch3+细胞比Lepr-Cre+Notch3-细胞更加静息。免疫荧光染色显示该亚群紧贴骨髓血管外壁,暗示其与血管内皮细胞之间可能存在通讯与互作。研究人员利用体外3D共培养体系发现,与骨髓内皮细胞共培养的BMSC更为静息,且显著上调Notch3。此外,通过分泌因子谱的分析,研究人员还发现Scf 和Cxcl12在衰老过程中显著下调,这部分解释了造血干细胞功能衰退的原因。
成骨细胞类群在小鼠骨折和亚致死剂量辐照后显著增加,拟时序分析展示了一个完整连续的成骨谱系细胞分化过程。转录调控网络分析发现转录因子Npdc1和Hoxb2在骨折样本中显著富集,暗示其可能具有调控成骨和成软骨分化的能力。研究人员通过慢病毒转染shRNA的方法在原代BMSC中分别敲降这两个基因,发现成骨和成软骨分化能力显著减弱。体内肾囊下移植实验同样证明Npdc1和Hoxb2是促进骨折修复的关键转录因子。
最后,研究人员还深入研究了位于骨外膜的Lepr-Cre+细胞类群,发现其比例在骨折和亚致死剂量辐照后显著提高。该类群不仅包含已经报道的骨膜干细胞(Periosteal stem cells, PSCs)【5】,还包含一个高表达Sca-1且具有很强成克隆能力的新颖细胞亚群。体外分化实验显示Sca-1+细胞成脂能力较强,而成骨和成软骨能力较弱,暗示其不具备SSC特性。有趣的是,这一结果与Ambrosi等人近期发现的Sca-1+细胞体外分化数据一致,提示该研究探讨的Sca-1+细胞很有可能来源于骨外膜而非骨髓【6】。
同济大学岳锐教授与浙江大学沈立教授为本文的共同通讯作者,博士研究生莫春阳和郭晶鑫为本文的共同第一作者。
原文链接:
https://www.embopress.org/doi/full/10.15252/embj.2021108415
参考文献:
1. Lei Ding, et al. Endothelial and perivascular cells maintain haematopoietic stem cells. Nature. 2012 Jan 25;481(7382):457-62.
2. Lei Ding, et al. Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature. 2013 Mar 14;495(7440):231-5.
3. Bo O. Zhou, et al. Leptin-Receptor-expressing mesenchymal stromal cells represent the main source of bone formed by adult bone marrow. Cell Stem Cell. 2014 Aug 7; 15 (2): 154-68.
4. Rui Yue, et al. Leptin Receptor promotes adipogenesis and reduces osteogenesis by regulating mesenchymal stromal cells in adult bone marrow. Cell Stem Cell. 2016 Jun 2; 18 (6): 782-796.
5. Shawon Debnath, et al. Discovery of a periosteal stem cell mediating intramembranous bone formation. Nature. 2018 Oct;562(7725):133-139.
6. Thomas H Ambrosi, et al. Adipocyte accumulation in the bone marrow during obesity and aging impairs stem cell-based hematopoietic and bone regeneration. Cell Stem Cell. 2017 Jun 1;20(6):771-784.e6.