2020年12月3日,我院王立铭实验室在Cell Research杂志上在线发表了题为‘A novel satiety sensor detects circulating glucose and suppresses food consumption via insulin-producing cells in Drosophila’的研究论文。该研究找到了了果蝇大脑中一种新型的饱觉感受器,通过它,果蝇能够有效地对其进食行为进行调节。
作为具有高级思维能力的人类,我们知道健康的生活需要机体维持能量的平衡,因而会对必须营养物质的摄入进行精确调节。然而这种行为却并不是我们特有的,其它被认为没有人类“聪明”的动物似乎也能通过高效的方式对它们的进食行为进行调节,达到能量状态最优化的结果。科学研究证明中枢神经系统在其中发挥了不可或缺的重要功能。包括人类在内的动物都能通过中枢神经系统实时地感知机体内部的能量和营养物质储备状态,并通过外周感知系统“探测”到环境中食物的分布情况,进而及时地对自己的行为进行精确校准,时刻保持自身的代谢水平处于平衡。而已有的科学研究成果表明,这一套精密的“调控机器”一旦被破坏,将会引发一系列严重的神经系统和代谢系统的疾病,包括进食障碍、肥胖症等。而“动物能够感知饥饿和饱腹的能力”又是这套“调控机器”中至关重要的一环。在哺乳动物中,饥饿是通过位于下丘脑的表达了刺鼠基因相关蛋白(AgRP, agouti-related peptide)的神经元感知的,相应地,饱腹感则是通过表达了阿黑皮素原(POMC,proopiomelanocortin)和黑皮质素受体4(MC4R,melanocortin-4 receptor)的神经元感知的,它们同样位于下丘脑,能够接收来自于循环系统、脂肪组织、肠道等部位传来的信号。这两类神经元的交替激活,代表了动物的饥饿或饱腹状态,从而促使它们对食物的摄取行为进行调节。
果蝇作为最经典的模式生物之一,除了具有大脑相对简单、易于对其神经元进行遗传操纵等优点,它还具有和哺乳动物相对保守的调控生理和代谢过程的关键因子,因此果蝇常常被用来作为研究动物进食行为的模式生物。浙江大学王立铭实验室长期致力于研究进食和代谢等相关行为的神经生物学机制。近年来,他们建立了比较完善的观测果蝇定量进食和觅食行为的研究范式,并利用这些范式研究了果蝇觅食行为的调控机制,研究结果表明食物中的营养成分不仅可以改变果蝇的进食行为,同时也能够改变它们的觅食行为1-4。
在这项研究中,为了解答“果蝇是如何感受体内的能量状态进而抑制其进食的神经内分泌机制”这个问题,研究人员利用MAFE范式对果蝇的进食体积进行定量测定的方式,对表达了神经系统特异神经肽的RNAi库进行了筛选。并且研究人员巧妙地采用了不能被代谢的左旋葡萄糖(L-glucose)作为测试材料,因为先前的研究结果表明具有营养的食物在被摄入后会激活营养感受器,促进果蝇的进食5,利用左旋葡萄糖可以避免食物营养成分的干扰。
筛选结果揭示果蝇速激肽(DTK,Tachykinin)及其受体TAKR99D通路是果蝇进食行为的抑制因子。激活DTK神经元会抑制果蝇的进食,反之,抑制DTK神经元则会促进果蝇的进食。我们因此可以假设果蝇的DTK神经元是饱觉感受器,它能够调控饱腹果蝇的进食行为。
实验结果进一步表明,饥饿果蝇的DTK mRNA表达量会下降,而重新进食则会诱导DTK mRNA表达量的上调;而且,抑制饱腹果蝇的DTK神经元活性能够增强果蝇对有营养的食物的偏好性,模拟了饥饿果蝇的表型。离体钙成像实验则表明,果蝇大脑中的2对DTK神经元能够被血淋巴中的主要碳水化合物右旋葡萄糖激活。
果蝇大脑中的胰岛素生成细胞(IPCs, insulinproducingcells)是果蝇中少数被研究得较为透彻的调控其进食和代谢行为的关键因子。IPC神经元能够间接地感知果蝇体内的营养状态,进而调控它们的代谢和进食行为6。通过GRASP(GFP Reconstitution Across Synaptic Partners)和光遗传等技术手段,研究人员发现TAKR99D神经元和IPC神经元是DTK神经元的下游神经元,而DTK-TAKR99D-IPC构成了跨2次突触的3层神经元环路。
为了研究“在生理条件下,DTK-TAKR99D-IPC环路如何调节果蝇的进食行为”。研究人员利用在体钙成像技术对进食的果蝇进行了观察,发现果蝇在摄入右旋葡萄糖后会快速激活TAKR99D神经元和IPC神经元。而人为激活IPC神经元则会抑制其进食行为,相反地,抑制TAKR99D神经元和IPC神经元则会促进其进食,这个结果与操纵DTK神经元的表型一致。
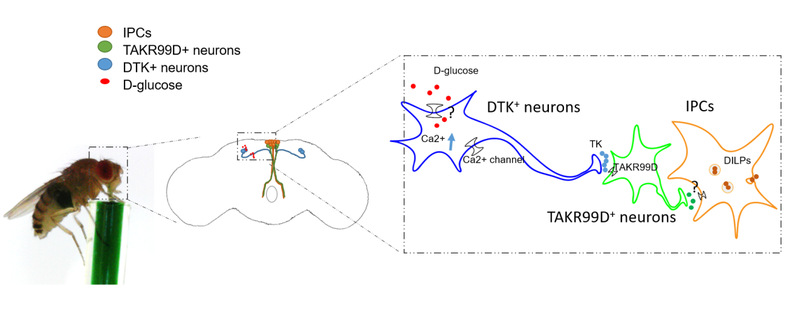
图一:果蝇检测体内能量水平抑制进食的机制示意图。
总结一下,这项研究揭示了果蝇大脑中一种由DTK-TAKR99D-IPC三层神经元构成的新型营养感受器,它可以快速地探测到发生进食行为的果蝇血淋巴中升高的右旋葡萄糖,从而抑制其进一步进食,有效地防止了果蝇对食物的过度摄食。
肥胖以及和肥胖相关的一系列疾病严重地影响着现代人类健康幸福的生活,各个国家的很多科学家们都致力于研究肥胖等相关疾病的形成机制以及防治手段。研究发现能准确及时地感知饱足感是防止肥胖发生的关键步骤,它能帮助人们“管住嘴”,能从源头上遏制肥胖和其相关代谢疾病的发生。而饱足感的实现需要“饱足中心”统筹整合不同组织器官释放的信号,这些信号则代表了机体不同营养物质的储备状态。本研究发现的新型营养感受器就在果蝇中发挥着“饱足中心”的作用,能有效精确地调控果蝇的食物摄取量。鉴于果蝇和包括人类在内的哺乳动物在代谢调控方面的同源性,我们相信该研究能够为哺乳动物如何感知饱觉的机制及其如何代谢系统疾病等问题的研究带来新的灵感。
这项研究得到了国家重点研发计划(2019YFA0801900及2019YFA0802400)等项目的资助。我院已毕业博士生祁伟为第一作者,博士后汪高航为第二作者。
参考文献
1.Yang, Z. et al. Octopamine mediates starvation-induced hyperactivity in adult Drosophila. Proceedings of the National Academy of Sciences of the United States of America (2015).
2.Qi, W. et al. A quantitative feeding assay in adult Drosophila reveals rapid modulation of food ingestion by its nutritional value. Molecular brain8, 87 (2015).
3.Tian, Y. & Wang, L. Octopamine mediates protein-seeking behavior in mated female Drosophila. Cell discovery4, 66 (2018).
4.Yang, Z. et al. A post-ingestive amino acid sensor promotes food consumption in Drosophila. Cell research28, 1013-1025 (2018).
5.Dus, M. et al. Nutrient Sensor in the Brain Directs the Action of the Brain-Gut Axis in Drosophila. Neuron87, 139-151 (2015).
6.Nassel, D.R., Liu, Y. & Luo, J. Insulin/IGF signaling and its regulation in Drosophila. Gen Comp Endocrinol221, 255-266 (2015).
原文链接:https://www.nature.com/articles/s41422-020-00449-7