2020年7月10日,我院佟超实验室在eLife在线发表题为“Miga mediated endoplasmic reticulum-mitochondria contact sites regulate neuronal homeostasis”的研究论文。随着人类寿命的延长,诸如帕金森氏病、老年痴呆等神经退行性疾病的发生日益普遍。然而,人们对这些疾病发生发展的分子机理还知之甚少,治疗和缓解这些疾病面临巨大挑战。神经退行性疾病是一大类神经系统疾病的通称,虽然症状各不相同,但因为都涉及到神经元的死亡,所以在致病机制上有很多类似之处。线粒体是细胞中的能量工厂和代谢中心,其功能异常与神经退行性疾病密切相关。线粒体在细胞中与负责蛋白和脂质合成的内质网存在紧密的接触,它们之间的接触位点被称为内质网-线粒体接触位点(ERMCSs)。ERMCSs参与胞内钙离子平衡、脂质转运、线粒体动态平衡、以及自噬等过程。然而,在高等真核生物中,ERMCSs的分子组成、功能以及其是如何被调控的仍不清楚。新近研究发现,老年痴呆患者神经元中ERMCSs增多,然而这一现象是否是老年痴呆的致病因素还不清楚。
在本项研究中,佟超教授实验室发现线粒体外膜蛋白Miga过度表达会显著增加ERMCSs,并导致严重的感光神经元退化表型。Miga与内质网蛋白Vap33相互作用介导内质网和线粒体的接触,当突变Miga的FFAT结构域或者在过表达Miga的时候敲低Vap33表达后,退化的视感光神经元得到了恢复。进一步研究发现,通过其他方式人为增加ERMCSs也会导致严重的感光神经元退化。暗示ERMCSs的增加确实是导致神经系统稳态异常的原因之一。
本研究还发现Miga存在多位点磷酸化修饰,不同位置的磷酸化具有不同的功能。Miga FFAT 结构域内部和附近的丝氨酸残基的磷酸化是其与VAP33结合以及介导ERMCSs形成所必需的。VAP33与Miga的相互作用促进了上游丝氨酸/苏氨酸簇的进一步磷酸化,从而微调了Miga的活性。蛋白激酶CKI和CaMKII参与了Miga的磷酸化。Miga哺乳动物同源基因编码的MIGA2蛋白在哺乳动物细胞中具有相似的功能。
本研究揭示了神经元内ERMCSs的异常可以直接导致神经元的退化,暗示干预ERMCSs很可能可以作为治疗老年痴呆和其他神经退行性疾病的手段。
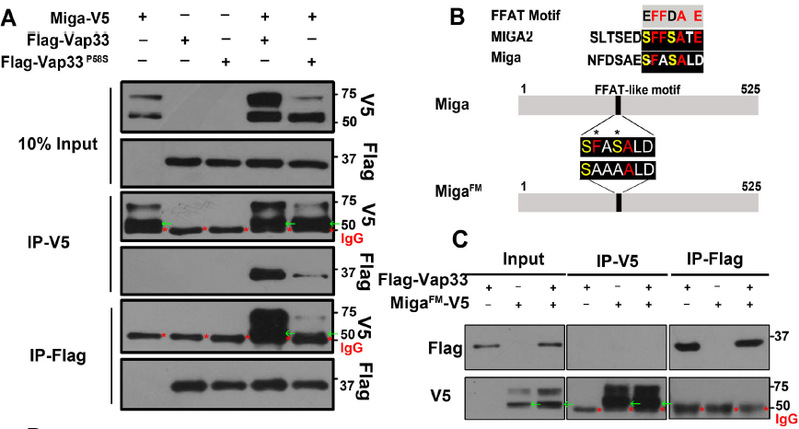
图1: Miga通过其FFAT结构域与内质网蛋白Vap33相互作用
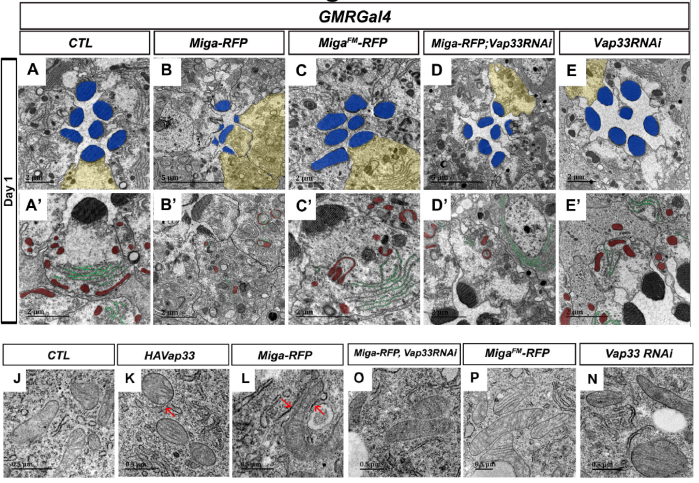
图2:Miga通过其FFAT结构域与Vap33相互作用来增加内质网和线粒体的接触从而导致果蝇神经退行性病变。蓝色表示的是感光小体(rhabdomeres),红色表示的是线粒体(Mitochondria),绿色表示的是内质网(ER),黄色区域部分表示的是感光细胞放大图相应的位置。红色箭头表示线粒体和内质网接触位点。
本研究得到了国家自然科学基金项目、国家重点研发计划项目、浙江省自然科学基金等项目的资助。研究中的质谱分析得到了本院质谱平台杨兵研究员的帮助。佟超教授实验室的博士生徐玲娜和硕士生王茜为论文的共同第一作者,佟超教授为该论文的通讯作者。浙江大学第二附属医院的王利权教授和杭州师范大学的刘俊平教授也协助了本项研究。
原文链接:https://elifesciences.org/articles/56584