2019年5月20日,我院朱永群实验室在Nature Microbiology杂志上发表题为“A bacterial effector deubiquitinase specifically hydrolyses linear ubiquitin chains to inhibit host inflammatory signalling”的研究论文,发现了来源于病原菌的特异切割线性泛素链的全新去泛素化酶,并揭示其在病原菌与宿主相互作用中的重要功能及机制。
泛素化是真核生物所特有的一种蛋白翻译后修饰,参与了真核生物众多的信号通路的调节。泛素在泛素激活酶E1、泛素结合酶E2和泛素连接酶E3的依次催化下,形成不同连接形式的多聚泛素链,和7种不同异肽键连接形式的泛素链和1种独特线性泛素链。线性泛素链是特殊的泛素连接酶复合物LUBAC能够催化,将泛素的C末端G76与上一个泛素分子的N端甲硫氨酸M1,通过肽键连接起来,首尾相连形成的。线性泛素链拥有独特的构象,调节很多重要的生理过程,如胚胎发育、自噬、NF-κB免疫通路等。真核细胞内同时也存在大量的去泛素化酶,能够水解泛素链,逆转泛素化过程。虽然细胞内存在数量庞大的异肽键泛素链的去泛素化酶,但线性泛素链在真核细胞内只有一个名为OTULIN的特异切割的去泛素化酶。虽然OTULIN能够水解线性泛素链,但是其是否真正地在细胞内广泛发挥线性泛素链去泛素化酶活性,还是只是作为调节LUBAC复合物活性的专用分子,还存在着不同的学术观点。
病原菌在与宿主长期相互斗争的过程中,通过各自独特的蛋白质分泌系统,分泌大量的毒性效应蛋白分子,作用于宿主细胞关键信号分子,调节宿主信号通路,拮抗宿主免疫防御和促进病原菌侵染。多个效应蛋白分子被报道具有去泛素酶活性,切割宿主的泛素链,从而干扰宿主泛素化过程。然而这些被报道的去泛素化酶效应蛋白全部都是切割异肽键连接的泛素链,主要偏好切割Lys63连接的泛素链。由于线性泛素链参与宿主免疫防御过程,具有很强的抑制细菌侵染的能力,因而在病原菌领域里长期以来存在着一个科学疑问:是否存在特异地切割线性泛素链的去泛素化酶效应蛋白分子。
为了解决这一问题,该研究首先设计了一个新型的针对病原菌的去泛素化酶活性筛选实验体系。通过这一筛选体系,该研究对43种不同病原菌进行了广泛的筛选,成功地发现嗜肺军团菌裂解液具有切割线性泛素链的活性,表明嗜肺军团菌可能含有切割线性泛素链去泛素化酶活性的效应蛋白分子。该研究随后从嗜肺军团菌中克隆149个功能未知的效应蛋白,并利用293T细胞过表达结合体外去泛素酶活性实验,从这些效应效应蛋白当中,成功鉴定出效应蛋白RavD,能够切割线性泛素链。随后的生化实验揭示,RavD只特异地切割线性泛素链,不能切割任何异肽键连接形式的泛素链,表明RavD是一个特异切割线性泛素链的去泛素化酶。
该研究进一步解析了RavD与线性泛素链的复合物结构,发现RavD具有独特的Cys-His-Ser催化三联体基序,其三维结构不同于先前发现的所有去泛素化酶,是一个全新的去泛素化酶。RavD利用两个不同的泛素结合表面,从而区别异肽键泛素链和线性泛素链,对线性泛素链进行特异的识别。在感染过程中,RavD利用其C末端结构域,特异地结合磷脂酰肌醇PI(3)P 和PI(4)P,从而在巨噬细胞内定位到嗜肺军团菌的膜泡上,然后突出其N端去泛素化酶结构域,持续性地切割膜泡上形成的线性泛素链,避免膜泡上线性泛素链的累积,达到抑制宿主NF-κB免疫信号的目的。RavD广泛地存在于军团菌属细菌中,其同源蛋白也都具有切割线性泛素链的去泛素化酶活性,表明切割线性泛素链是军团菌属细菌在宿主细胞内生存的一个普遍机制。
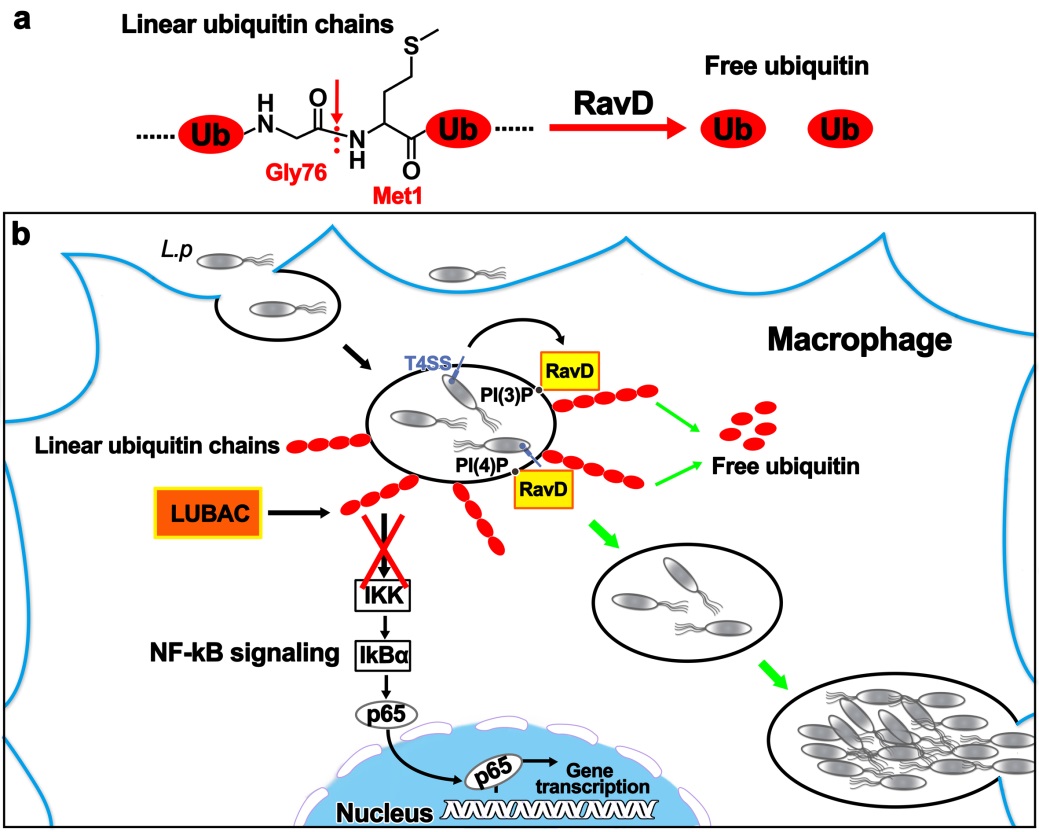
图2. RavD作用机制模式图。a. RavD水解线性泛素链的酶学活性示意图。b. RavD在嗜肺军团菌感染过程中的作用机制模式图。RavD被四型分泌系统分泌后,在宿主巨噬细胞内定位到嗜肺军团菌膜泡结构上,清楚膜泡上的线性泛素链,抑制宿主NF-κB免疫通路。
这项研究首次发现一个特异地切割线性泛素链的全新去泛素化酶,解决了病原菌领域的一个长期科学问题,发现了病原菌抑制宿主NF-κB免疫信号通路和泛素化信号通路的一个新机制,以及揭示了军团菌属病原菌一个普适的胞内生存机制。另外,该研究所建立的筛选体系将帮助人们发现更多的病原菌去泛素化酶。由于与真核去泛素化酶完全不同,RavD可以被开发成研究线性泛素链的全新研究工具,促进真核细胞信号转导的研究。
朱永群实验室的博士生万木阳和博士后王小飞为本文的共同第一作者,朱永群教授为本文的通讯作者。参加该研究的还有朱永群教授实验室研究生的黄春峰、徐丹丹、王钊和浙江大学生命科学学院的周艳研究员。该工作获得国家自然科学基金委、科技部、国家万人计划青年拔尖人才、浙江省万人计划科技创新领军人才和中央高校基本科研经费的资助。