2016年7月1日,我院徐平龙实验室与冯新华实验室合作在Science新子刊Science Advances上发表题为“PPM1A silences cytosolic RNA sensing and antiviral defense through direct dephosphorylation of MAVS and TBK1”的研究论文。
宿主细胞的固有免疫应答在抵抗病毒感染中起关键作用。RNA病毒感染细胞后,宿主细胞能通过位于胞质内的RIG-I样模式识别受体(RLR)侦测到病毒RNA,通过位于线粒体的接头蛋白MAVS,激活TBK1与IKKε激酶从而活化转录因子IRF3,并激活NF-κB信号通路,最终诱导干扰素、干扰素诱导基因和促炎症细胞因子等一系列抗病毒因子生成。其中,接头蛋白MAVS和激酶TBK1的磷酸化修饰在抗病毒固有免疫应答中起关键作用,但对其去磷酸化调控所知甚少。
利用蛋白磷酸酶cDNA文库,徐平龙实验室与冯新华实验室在细胞模型中筛选了调控I型干扰素生成的抗病毒固有免疫应答的蛋白磷酸酶。其中鉴定了金属离子依赖的蛋白磷酸酶PPM1A能够显著抑制宿主细胞的I型干扰素生成,并证明PPM1A能通过与TBK1激酶形成内源复合体,直接移除TBK1的Ser172位点磷酸化;PPM1A并能通过TBK1与IKKε激酶被招募到接头蛋白MAVS上,从而也直接移除MAVS的磷酸化修饰。因此,PPM1A的敲除能显著提升细胞质RNA识别通路的激活,以及细胞与小鼠的RNA病毒抗性。相反,PPM1A过表达则强烈抑制细胞与斑马鱼的I型干扰素生成和病毒抵抗能力。该研究不仅在不同模式动物中鉴定了PPM1A是I型干扰素生成的关键生理调控因子,也鉴定了PPM1A为MAVS这一关键抗病毒接头蛋白的首个去磷酸化修饰酶。这些发现为理解宿主固有免疫的机制和发展潜在的抗病毒防治手段提供了新的理论与实验依据。
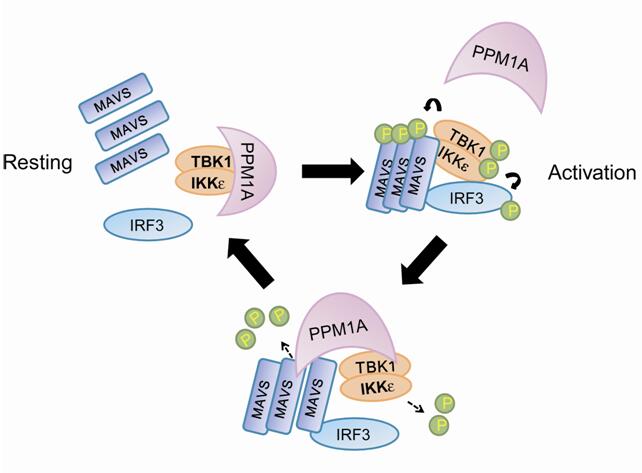 |
| PPM1A介导的MAVS/TBK1去磷酸化修饰避免了抗病毒防御的泄露或过强应答 |
本研究在我院徐平龙实验室与冯新华实验室合作开展并完成,实验室2013级硕士生向尉文和张倩分别为论文的共同第一作者,冯新华教授和徐平龙教授为本文通讯作者。该研究受到科技部973计划(2015CB553800)、国家自然科学面上基金(81472665)等经费资助。